RESERCH CONTENT
現在日本において、緑内障、糖尿病網膜症、加齢黄斑変性、網膜色素変性が主な中途失明の原因となっています。緑内障では、眼圧を下げる治療が行われますが、眼圧が十分に下げられない症例や眼圧がコントロールされてもなお視野悪化が進行する症例が少なくありません。また、萎縮型加齢黄斑変性や網膜色素変性には、確立された治療法がありません。緑内障では、網膜の神経節細胞が、加齢黄斑変性や網膜色素変性では、視細胞や網膜色素上皮細胞が変性・脱落することによって、視野や視力の悪化が起こります。したがって、これら網膜の神経細胞の変性を抑制することができれば、現在治療法のない多くの眼疾患に新たな治療の可能性が広がると考えます。そこで私たちは、網膜神経細胞を保護する可能性を持つ薬剤を用いた神経保護治療研究を行っています。
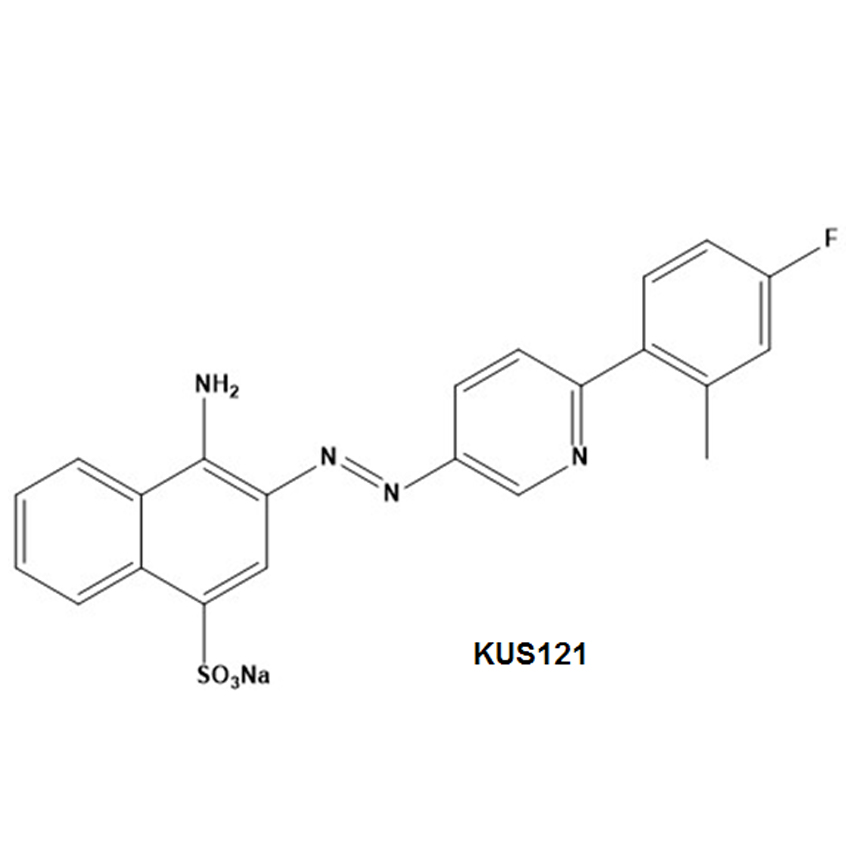
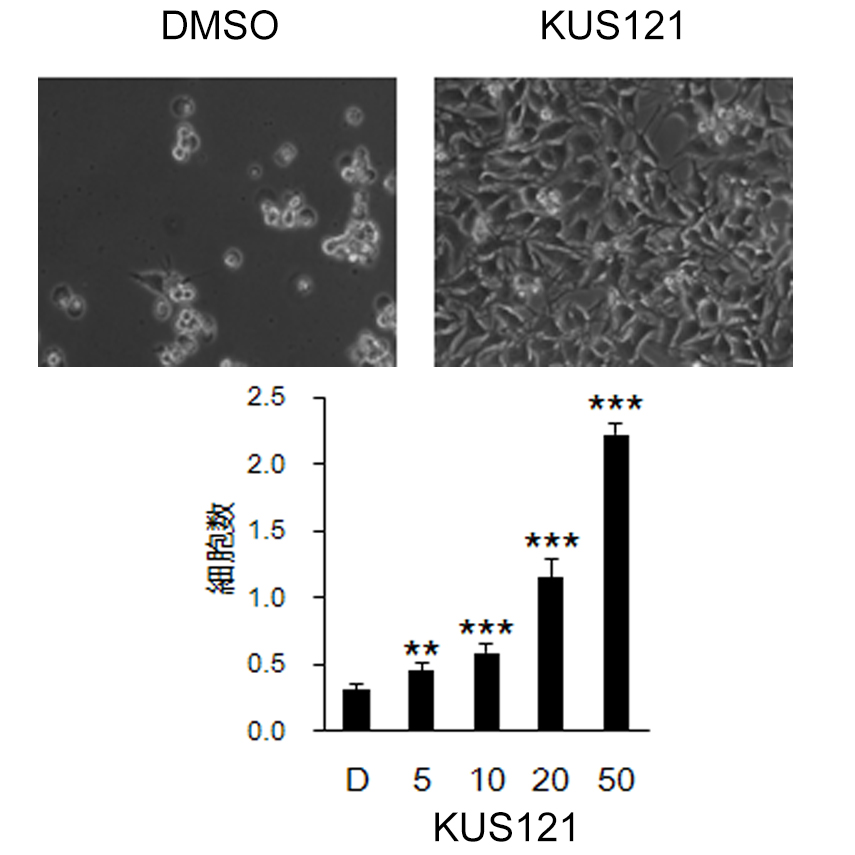
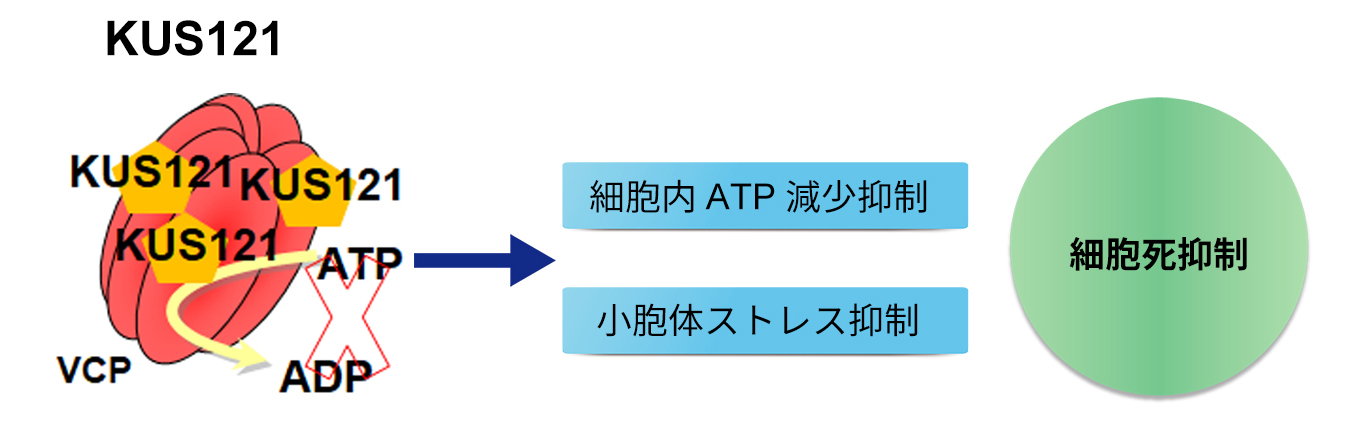
VCP(valosin containing protein)は、細胞が異常蛋白質の蓄積や酸化ストレスに遭遇した時にそれらに対してストレス応答を引き起こす過程で重要な働きをする蛋白質です。京都大学生命科学研究科の垣塚彰教授の研究室では、このVCPの ATPaseに対する阻害剤の開発に成功し(Kyoto University Substance: KUS化合物)、この化合物には、種々のストレス時のATPの減少を抑制し、その結果、組織を超えてin vivoでの細胞死を抑制する作用があること、網膜変性モデル(rd10、rd12、網膜色素変性モデルウサギ)、緑内障モデル(NMDA硝子体内注射モデル、GLAST欠損マウス、DBA2J高眼圧モデルマウス)、虚血性眼疾患モデル(虚血再灌流ラット)に投与することで、疾患の発症と進行の抑制効果をもつことを明らかにしてきました。
さらに、細胞内のエネルギー源として分岐鎖アミノ酸に着目し、その細胞保護作用、網膜色素変性や緑内障の疾患モデル動物における進行抑制効果を明らかにしつつあります。
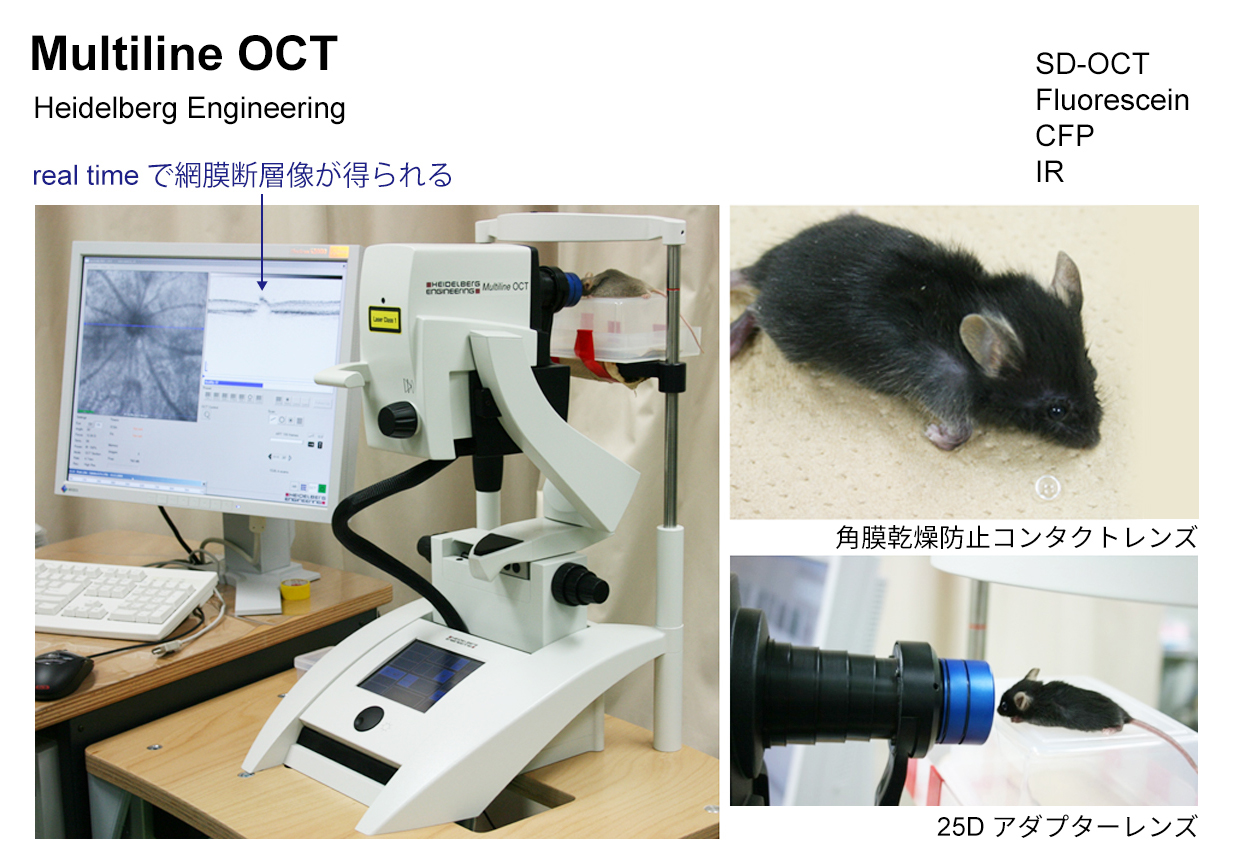
これらの実験動物を用いた研究では、動物専用の光干渉断層計(OCT)や蛍光眼底撮影など最新のイメージング器機を駆使し、同一個体による継時変化を、より客観的にとらえる工夫をしています。また、視力検査・視野検査の代わりに、網膜電図(ERG)による視機能評価を行っています。
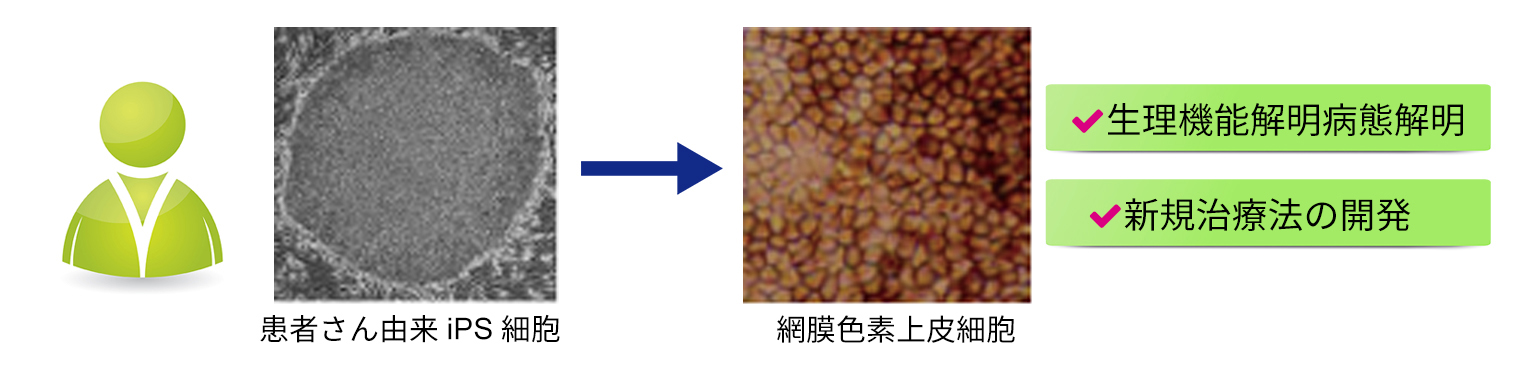
最近では、患者さんから採取した組織から樹立したiPS細胞を網膜細胞へ分化誘導させ、その形態や機能解析を行い、どのように病気が発症・進行するのかを明らかにする研究を行っています。病態が明らかになれば、その治療法開発にもつながる可能性が高くなります。
私たちが研究開発してきたKUS剤に関して、視力改善治療法のない網膜中心動脈閉塞症の急性期にKUS剤を硝子体内投与し、その安全性と視力改善効果を検討する医師主導治験(第1/2相試験)(UMIN000023979)を実施いたしました。近い将来、新たな神経保護治療薬として、患者さんにお届けできることを期待しています。
今後も、現在治療法のない眼疾患に対して新たな治療法を開発すべく、基礎研究(ベンチ)から臨床研究(ベッドサイド)まで、そして多角的に、研究に取り組んでいきます。 (池田 華子)